

影响因子:6.2
伯豪技术服务:单细胞转录组测序
研究背景
胃癌(GC)是全球癌症相关死亡的第三大原因,预后普遍较差。胃癌干细胞(GCSCs)因其自我更新能力、异质性分化潜能以及对化疗和靶向治疗的强耐药性,被认为是肿瘤发生、进展、复发和治疗抵抗的关键驱动因素。尽管靶向Wnt/β-catenin信号通路(GCSCs干性和耐药性的核心调控通路)是极具前景的策略,但目前缺乏临床可用的有效抑制剂。
主要技术
单细胞转录组测序
(技术服务由伯豪生物提供)
实验材料
人类GC细胞系(MGC-803、SGC-7901、BGC-823、MKN-45);4至6周龄雄性裸鼠。
结论
通过高通量筛选临床获批药物库,发现抗生素药物氯福克酚(Clofoctol, CFT) 能高效抑制β-catenin表达,显著削弱GCSCs干性,并通过结合RanBP2蛋白诱导TNF介导的程序性坏死,为胃癌治疗提供了新的候选策略。
实验结果
1. 高通量筛选鉴定CFT为强效β-catenin抑制剂
筛选策略: 使用实时定量PCR(RT-qPCR)检测206种FDA批准的无明确靶点药物对胃癌细胞系MGC-803中β-catenin mRNA水平的影响。
关键发现:
10种药物(4.85%)能将β-catenin mRNA抑制至对照组50%以下(图1A, B)。
CFT表现出最强的抑制效果,显著降低多个GC细胞系(MGC-803, SGC-7901, BGC-823, MKN-45)的β-catenin mRNA和蛋白水平(图1C,附图S1A)。
细胞效应初探:
常规培养下,CFT(≤10 μM)在前48小时对细胞活力和凋亡无显著影响(附图S1B-D)。
营养应激增强CFT效应: 在低血清(1% FBS)模拟的微环境压力下,CFT处理7天后显著抑制GC细胞增殖,诱导S期阻滞并促进细胞凋亡(图1D-F,附图S2A-C)。
协同化疗: CFT与5-氟尿嘧啶(5-Fu)联用表现出显著的协同抗肿瘤效应(附图S2E, F)。
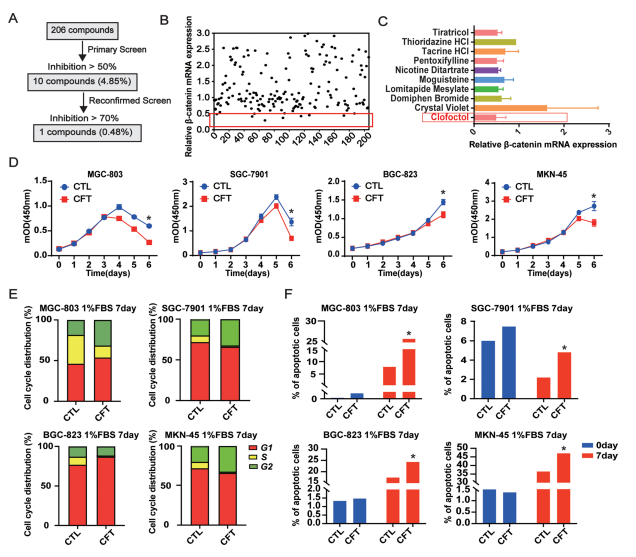
图1. CFT在低血清培养基中抑制β-catenin和细胞生长
2. CFT有效抑制GCSCs干性及致瘤性
干性标志物下调: CFT处理显著降低干性相关基因(Nanog, Oct4, Survivin, Sox2, Lgr5)的mRNA表达(图2A)。
自我更新能力受损:
体外球体形成: CFT处理显著降低GC细胞形成肿瘤球体的频率和能力(图2B,附图S3A, B)。
集落形成: CFT处理显著减少GC细胞的贴壁依赖性集落形成单位(CFU)(图2D)。
GCSCs标志物减少: 流式细胞术(FCM)分析显示,CFT处理显著降低CD44⁺/CD133⁺双阳性细胞群以及高醛脱氢酶活性(ALDH⁺)细胞群的比例(图2E, F,附图S4A, B)。
体内致瘤性减弱:
有限稀释实验: 将不同数量(10⁴, 10⁵, 10⁶)的GC细胞皮下接种裸鼠,CFT处理组形成的肿瘤更少、更小,表明CFT降低了具有肿瘤起始能力的细胞比例(图2G)。
次级移植瘤实验: 将CFT处理组来源的原代肿瘤细胞再次接种小鼠,形成的次级肿瘤数量和体积显著小于对照组,证明CFT处理可长期抑制肿瘤再生能力(图2H)。
迁移侵袭抑制: CFT通过下调上皮间质转化(EMT)相关蛋白抑制GC细胞的迁移和侵袭能力(附图S5A-D)。
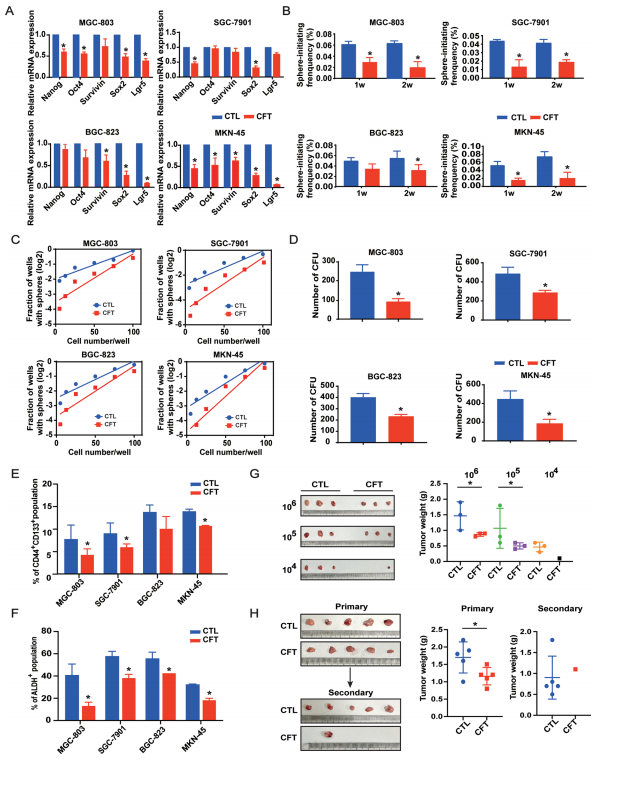
图2. CFT在体内和体外抑制GC细胞干性
3. CFT选择性杀伤GCSCs并诱导凋亡/坏死
模型建立: 从4株GC细胞系和2例GC患者原代细胞中分离培养GCSCs。
选择性杀伤:
CFT(10 μM)能显著抑制6种不同来源GCSCs的活力,而同等剂量对普通GC细胞或正常细胞(HUVEC, 293T, GES-1, H9)影响甚微(图3A-C,附图S6A, B)。
GCSCs通常对化疗药5-Fu和顺铂(Cis)耐药,但CFT对其表现出强效杀伤作用(图3A)。
诱导细胞死亡:
FCM(Annexin V/PI)和Calcein-AM/PI活死染色证实CFT显著增加GCSCs的凋亡/死亡细胞比例(图3D, E,附图S6C, D)。
人凋亡抗体芯片: CFT处理改变多个凋亡相关蛋白表达,包括Caspase-3、HSP27、CytoC、FasL、Survivin和XIAP(图3F,附图S6E)。
活性氧积累: CFT诱导GCSCs内活性氧(ROS)显著累积(附图S6F)。
体内抗GCSCs活性:
裸鼠移植瘤模型: 将SGC-7901来源的GCSCs接种裸鼠,肿瘤体积达50 mm³后腹腔注射CFT(30 mg/kg/天,连续11天)。CFT显著抑制肿瘤生长,且不显著影响小鼠体重(图4A-D)。
机制验证:
免疫组化/免疫荧光:CFT处理组肿瘤中Cleaved Caspase-3表达升高(凋亡增加),CD44⁺/CD133⁺细胞比例降低(干性减弱)(图4E-G)。
单细胞RNA测序(scRNA-seq): 分析CFT处理组肿瘤细胞组成,发现具有高干性基因(NEAT1, COL7A1, MALAT1, IMMP2L)特征的细胞簇(Cluster 5)比例显著减少,且该簇细胞处于分化早期(图4H-K,附图S7C-E)。
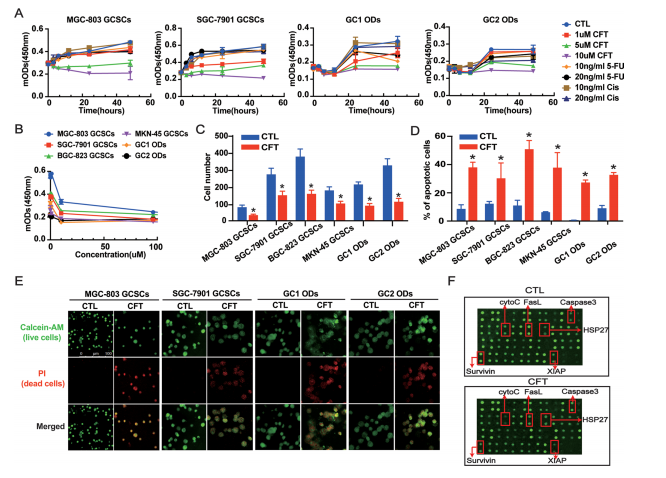
图3. CFT抑制GCSC活率并诱导凋亡
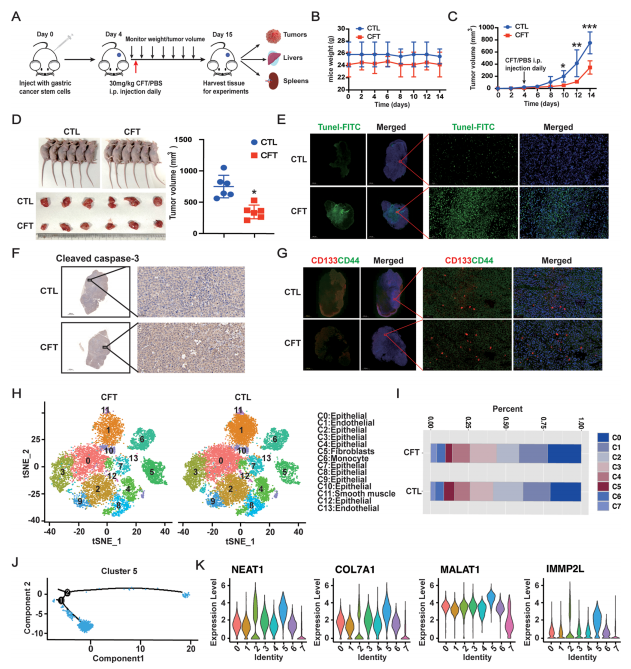
图4. CFT在体内诱导GCSC凋亡
4. 分子机制:靶向RanBP2调控SerpinE1/β-catenin轴与TNF坏死通路
RNA-seq揭示关键通路:
CFT显著下调SerpinE1(与GC不良预后正相关)表达(图5B,附图S9A-D)。
CFT显著上调TNF表达,并富集到“细胞因子-受体相互作用”、“凋亡”和“坏死性凋亡”相关通路(图5D-F,附图S8C-F)。
蛋白互作(PPI)网络分析确认TNF是调控凋亡/坏死网络的核心节点(图5G)。
qRT-PCR验证CFT上调多个坏死性凋亡相关基因(TNF, IL6, IL18等)(图5H, I)。
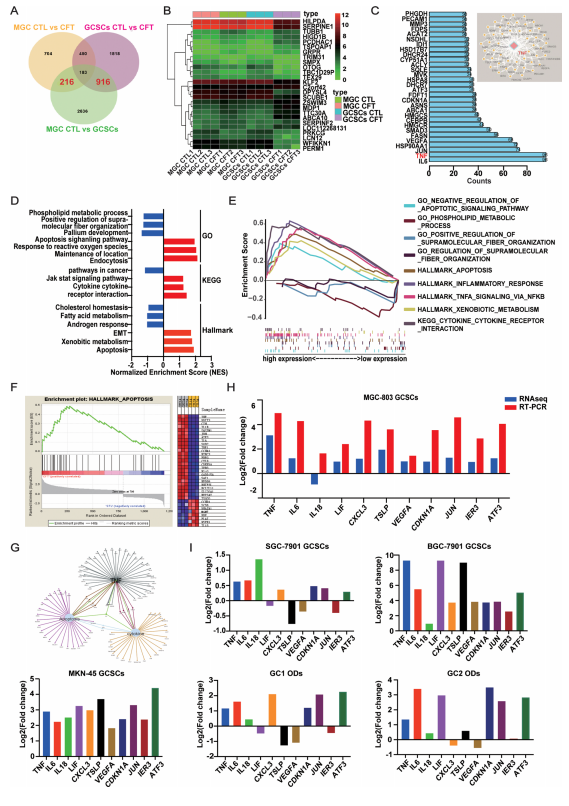
图5. SerpinE和TNF是CFT的靶点
SerpinE1是CFT抑制干性的关键下游因子:
回补实验:在GC细胞中过表达SerpinE1,可部分逆转CFT对β-catenin的下调作用(图6A,附图S9E-G)。
过表达SerpinE1显著上调干性基因(Nanog, Oct4等)表达,并增强集落形成、球体形成和致瘤能力,而CFT处理能拮抗这些效应(图6B-G,附图S9H, I)。
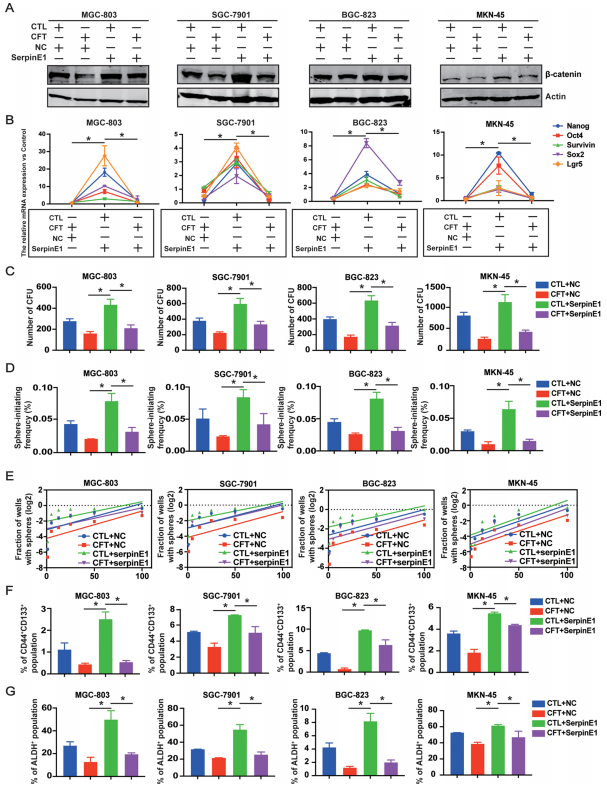
图6. SerpinE1与CFT介导的GC细胞干性抑制有关
CFT激活TNF介导的程序性坏死(Necroptosis):
CFT显著上调GCSCs中TNF mRNA和磷酸化RIPK1、RIPK3、MLKL蛋白水平(图7B, C)。
使用特异性RIPK1抑制剂Necrostatin-1 (Nec-1) 可剂量依赖性地阻断CFT诱导的TNF上调和细胞凋亡/坏死(图7D, E),证明CFT通过TNF-RIPK1/RIPK3/MLKL通路诱导GCSCs坏死性凋亡。
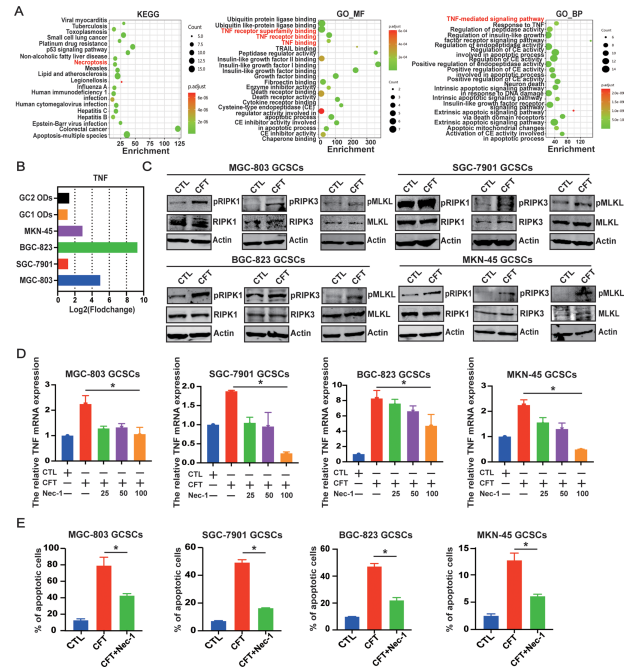
图7. CFT诱导TNF介导的GCSC坏死性凋亡
CFT直接靶向结合RanBP2:
网络药理学与分子对接: 预测出25个CFT潜在靶点,PPI网络分析及GC表达数据提示RanBP2(SUMO E3连接酶)是关键候选靶点(图8A,附图S10A-H)。
分子对接: CFT通过氢键与RanBP2的PHE-110残基稳定结合(图8B)。
DARTS验证: CFT结合可保护RanBP2蛋白免受蛋白酶降解(图8C)。
分子动力学(MD)模拟: 模拟CFT-RanBP2复合物100 ns动态,显示复合物RMSD、Rg、RMSF值稳定,结合自由能分解确认PHE-110等残基对结合贡献大,证实两者结合稳定(图8D-H,附图S10I)。
功能验证: 敲低RanBP2:
特异性降低SUMO1(而非SUMO2/3/4)蛋白水平(附图S10K)。
逆转CFT对SerpinE1、β-catenin和SUMO1的下调作用(图8I),证明RanBP2是CFT发挥功能的上游靶点。
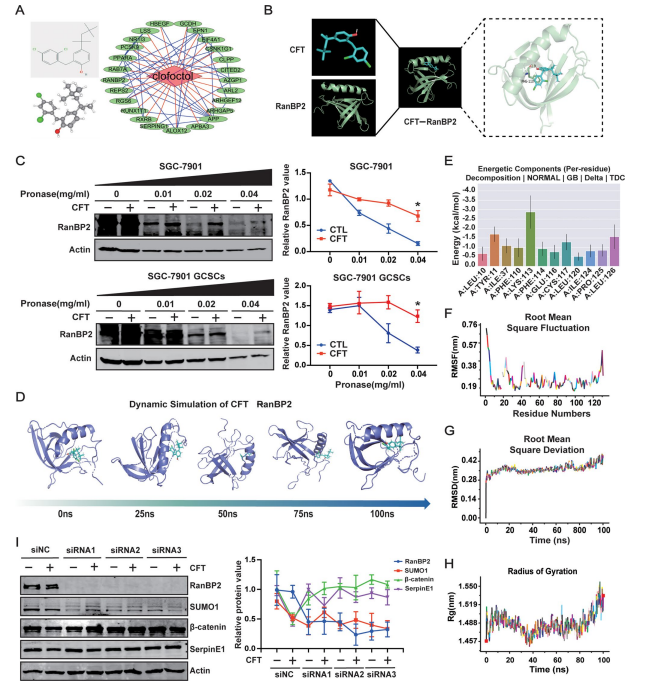
图8. CFT与RanBP2结合调控靶蛋白
5. 机器学习构建CFT疗效预测模型
模型构建:基于RNA-seq数据,应用Lasso回归(LR)、支持向量机(SVM)和随机森林(RF)三种机器学习算法筛选特征基因。
核心基因:整合分析得到77个候选基因,进一步结合TCGA胃癌转录组数据,最终确定13个基因构成预测模型(附图S11A-C)。
预后价值:
根据风险评分将TCGA胃癌患者分为高风险组和低风险组。高风险组患者总生存期(OS)显著短于低风险组(P=0.00336)(附图S11D)。
多因素Cox回归确认年龄、肿瘤分期和风险评分是独立预后因素(附图S11F)。
风险评分对3年内预后具有良好预测价值(ROC曲线下面积AUC=0.627)(附图S11E, I)。
列线图整合风险评分与临床特征,可直观预测患者生存(附图S11G, H)。
总结
靶点结合:CFT直接结合SUMO E3连接酶RanBP2。
干性抑制:通过RanBP2下调SerpinE1表达,进而抑制β-catenin信号通路,削弱GCSCs干性、自我更新和致瘤能力。
诱导死亡:通过RanBP2激活TNF介导的RIPK1/RIPK3/MLKL依赖性程序性坏死途径,选择性杀伤耐药性GCSCs。
预测工具:基于13个基因的机器学习模型可预测胃癌患者预后及潜在CFT治疗反应。
临床转化价值:
老药新用:CFT作为已获批的抗菌药物,其安全性已知,重新定位用于胃癌治疗可加速临床转化。
靶向GCSCs:CFT能有效清除对传统化疗耐药的GCSCs,为克服胃癌复发和转移提供了新策略。
联合治疗:CFT与化疗药物(如5-Fu)联用展现协同效应,具有临床联合用药潜力。
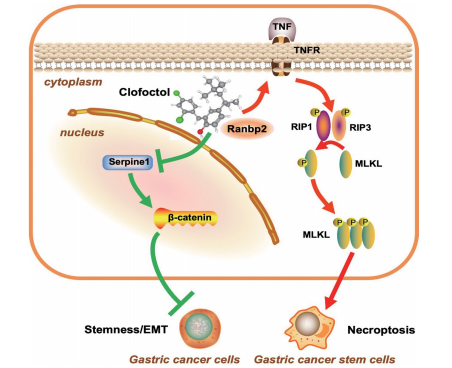
图9. 机制图:CFT与RanBP2结合,诱导坏死性凋亡,抑制干性
参考文献:
Liu Y, Ma Y, Zhou B, et al. Clofoctol impairs the stemness of gastric cancer and induces TNF-mediated necroptosis by directly binding to RanBP2. Cell Mol Life Sci. 2025;82:194.
